
| I:放射線生物学の成果にもとづく放射線発がんのリスク評価 | ||
| 1.LNT仮説への挑戦 | ||
| (1)放射線発がんの主経路は突然変異ではない | ||
| 1)はじめに | ||
| 2)放射線細胞がん化は単純な突然変異の積み重ねでは起こらない | ||
| 3)ヒト以外の細胞は簡単にがん化する | ||
| 4)放射線によるバイアスタンダー効果と遺伝的不安定性 | ||
| 5)がん化した細胞では、染色体の数の異常が起きている | ||
| 6)放射線発がんの標的はタンパク質である | ||
| 7)結論 | ||
| 8)参考文献(略) | ||
I:放射線生物学の成果にもとづく放射線発がんのリスク評価
1.LNT仮説への挑戦
(1)放射線発がんの主経路は突然変異ではない
1)はじめに
今から 30 年ほど前に、ある雑誌に“細胞がん化のメカニズム-その渾沌とした現状”と言う総説を書いた1)。私は、当時、まだ、放射線生物学に踏み入れたばかりの駆け出し研究者であったが、“自分が放射線発がんの仕組みを解明するのだ“と夢見て居た時代であったことを懐かしく思い出す。当時は、ワインバーグらによってがん細胞から分離した DNA を正常細胞に移入することによって細胞をがん化できることが発見され、がん遺伝子の存在が次第に明らかにされてきた時代だったので、総説の内容は自ずと“発がんの突然変異説”の是非を問う構成となっている。しかし、そのような目的を持って総説を書き進めながら、その文面からは、当時、私自身が、“放射線発がんの原因は単純な遺伝子突然変異では説明できない”ことに苛立ちを感じていたことが感じられる。今、この総説をあらためて読み返すと、この 30 年近く、細胞がん化の機構解明を目指してきた研究者が、依然として細胞がん化の本体を明らかにしていないことに気づかざるを得ない。発がんや分化といった高度に発展した生命の仕組みの巧妙さに改めて感慨を深めるとともに、その本体に迫るべく新たな挑戦が必要であると感ずる。本稿では、この 30 年の間におこなった我々の研究グループの成果をもとに、放射線による細胞がん化の標的は DNA ではない可能性を指摘し、“発がんの突然変異説に対する異論”を解説してみようと思う。
2)放射線細胞がん化は単純な突然変異の積み重ねでは起こらない
がんは多段階の形質変化が積み重なって起きることが臨床的な観察から古くから知られていた。そして段階的に進む形質変化のそれぞれに密接に関係する遺伝子が存在し、その遺伝子に突然変異が起きることが発がんの第一歩であり、アクセルであると考えられてきた。この考え方は、“発がんの突然変異説”であり、現在も最も有力な発がんの仮説である。その説では、発がんは DNA にがん化損傷が生ずる過程(イニシエーション)と初期過程を終えた、自分を取り巻く様々な要因の影響を受けてがん化する過程(プロモーション)を経て起きるという多段階説が基礎となっている。しかし、依然として、この仮説は実証されておらず発がんの全容を見渡すという視点でみると何らかの矛盾を伴っていることが多い。多くの矛盾を指摘することが出来るが、30 年前に指摘しながら依然として解決されていない疑問は、(1)発がん頻度が個々の体細胞突然変異頻度より遥かに大きいのはなぜか?(2)ヒト細胞とマウス細胞の突然変異感受性は違わないにもかかわらず、ヒト細胞だけが試験管内で発がんさせることが極めて難しいのはなぜか?ということに尽きると思う。
我々は、X 線を照射したゴールデン・シリアン・ハムスター(SHE)細胞を二群に分け、一方で細胞悪性形態変化(malignant morphological change)を指標にして細胞がん化頻度を求め、他方で 6 チオグアニン抵抗性の獲得を指標にHGPRT遺伝子座における体細胞突然変異頻度を調べた2,3)。その結果を図 1 に示す。読者は、この図から何を気づかれるだろうか?幾つかの特徴を指摘することが出来るが、まず、第一に、細胞がん化と突然変異誘導パターンが全く異なることに気がつかれるだろう。突然変異の誘導は、生存率曲線の肩の領域に相当する比較的低線量域(1.5Gy 以下)では殆ど増加がみられないが、2Gy 以上の線量域になると線量に比例して指数関数的に増加する。しかし、細胞がん化は、これとは全く異なるパターンをとり、突然変異が殆ど誘導されない 1.5Gy 以下の線量域で効率的に誘導される。1.5Gy 以下の線量域における細胞がん化の誘導頻度は平均 3×10-3/Gy で、変異の誘導頻度の 10-5/Gy に比べて同じ線量域の突然極めて高いことがわかる。
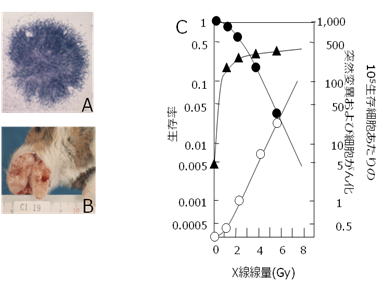
図1 X 線照射されたシリアンハムスター細胞における突然変異頻度と細胞がん化頻度。細胞の生存率(●)はコロニー形成法、突然変異頻度(○)は、ハイポキサンチン・グアニン・ホスホリボシル・トランスフェラーゼ遺伝子座の突然変異、細胞がん化は写真 A に示す悪性形態コロニーの出現率(▲)で判定した。悪性形態コロニーから採取した細胞は、B に示すようにハムスターほほ袋に腫瘍を形成することが出来る。(Watanabe et al. 1980より引用、図改変)
放射線による突然変異の誘導頻度は、ラッセルらの膨大な数のマウスを使った実験の結果からも10-5/Gy 近辺の値を取ることは良く知られており、発がんに関わるがん関連遺伝子でも大差はないとみて問題はないであろう。私は、試験管内細胞がん化頻度と同程度の頻度で起きる体細胞突然変異を知らない。しかし、細胞発がんの頻度は、一般的な体細胞遺伝子で観察される変異頻度に比べ極めて高い。こうした事実は、多くの研究者によって繰り返し報告されてきたが、現在まで満足いく説明はなされていない。この疑問について、多くの研究者は、試験管内細胞がん化系が使用している細胞の悪性形態変化は、がん化の指標として不十分なのではないかと疑っている。しかし、私たちが使用したシリアンハムスター胎児細胞(SHE 細胞)に限らず、C3H10T1/2 細胞や Balb 3T3 細胞などの試験管内細胞がん化実験に汎用されているマウス由来細胞で、悪性形質転換したコロニーから採取した細胞は、確実に基質非依存性増殖能(軟寒天中での増殖能)を獲得し、かつヌードマウスなどへの移植性を獲得している。確実にがん化が運命づけられているといえる。
このように明確で発がん機構の基盤を揺るがすような矛盾であっても、そのまま四半世紀に渡って解決されないままに残されてきた。当時、私は、こうしたことが生ずる原因として、(1)細胞がん化に関係する遺伝子のサイズが極端に大きいのではないか、(2)DNA 損傷修復機構に突然変異を起こしやすいものが存在するのではないか、(3)非遺伝的変化が細胞がん化の原因ではないかと考察していた2-4)。しかし、がん化に関係する遺伝子として極端にサイズの大きい遺伝子は、未だ知られていない。また、確かに、突然変異を起こしやすい DNA 損傷修復機構の存在やDNA損傷修復時の細胞周期チェックポイントの不備が複製異常を起こし細胞をがん化させる可能性も指摘されている。しかし、これらの現象が生じなくても細胞がん化は容易に起きる現象である。
3)ヒト以外の細胞は簡単にがん化する
その後、長年に渡る細胞がん化研究の結果から、私は“細胞はがん化しないのが通常の姿ではなく、がん化するのが通常の姿ではないかと疑うようになった。通常、細胞がん化実験では無限増殖能を獲得し造腫瘍性を持たない細胞が使われ、その細胞ががん細胞の持つ形質のどれかを発現するようになれば,形質転換を起こしたと判定される。この判定に使われる形質には細胞形態の変化、軟寒天中でのコロニー形成能の獲得、フォーカス形成などあり、最終的には、ヌードマウスなどへの移植能獲得で発がんと判定される。これまで試験管内細胞がん化実験系として C3H10T1/2 細胞や Balb3T3 細胞など無限増殖能を持ち、厳格な接触増殖阻止能を持つ細胞であり接触増殖阻止能の喪失を細胞がん化と判定するものである。これらの細胞は、通常の培養状態下では一層にしか増殖しないが発がん剤処理されると細胞が細胞の上に重なり合って増殖して数層に盛り上がった細胞の塊(フォーカス)を形成する。極めて感度の良い手法として今でも試験管内細胞発がん実験系として利用されている。しかし、これらの細胞の最大の欠点は、この細胞がすでにがん細胞の最大の特徴である無限増殖能を持ち、染色体の不安定性を示し、細胞密度や血清濃度を低く抑え注意深く培養しないと容易に自然がん化することである。この欠陥を克服する為に、私達は、発生時期を揃えた様々なマウス、シリアンハムスター、ラットおよびヒトの胎児のカーカスから調整した初代培養細胞を使った実験系を開発して放射線や化学発がん剤による細胞がん化メカニズムの解明を試みてきた。
これらの実験系を使って細胞がん化のメカニズムに関する研究結果を積み重ねてきたが、新たな多くの疑問が生じてきた。一番重要な疑問は、これらの実験系ではなぜパーセント以上の極めて高い頻度で細胞が無限増殖能を獲得し腫瘍性を獲得することにある。我々の実験では、シリアンハムスター胎児細胞を始めとするげっ歯類細胞を培養する際、コンフルエント状態を頻繁に経験させると、ほぼ 100% 自然にがん化させることが出来るようになった5)。その頻度は、平均的な体細胞突然変異頻度に比べて 103 から 104 という桁違いに大きい。しかし、ヒト胎児細胞ではそうした現象は見つからない。その結果から、我々は、細胞のがん化の初期過程には、非遺伝的経路が重要な役割を果たしており、ヒト細胞では、その経路が厳密に制御されているのではないか?と考えている。
細胞がん化の過程に非遺伝的経路が重要な働きを果たしていることは、これまでにも多くの研究で指摘されてきた。Kennedy ら(1984)は、放射線照射された C3H10T1/2 細胞における細胞がん化フォーカスの出現頻度は、放射線を照射後、フォーカスアッセイのために植え込む細胞数を希釈してコンフルエントに達するまでの細胞分裂回数を増やすほど増加することを報告した。この現象の解釈は難しいが、彼女らは、放射線による細胞がん化には、二つの事象が必要であり、第一の事象は、放射線被曝で極めて高い頻度で被曝したほとんどの細胞に誘導されるが、第二の事象は細胞分裂に絡んで誘導されるもので低い頻度でしか起こらないものであると推測した。そのため、放射線照射後の細胞分裂回数が多い細胞集団ほど細胞がん化頻度は高くなる。第一の事象は、通常の体細胞突然変異頻度より極端に高く、集団のすべての細胞に生ずるもので遺伝的変化ではなく非遺伝的変化であると予想している。このことは、細胞がん化につながる非遺伝的変化が細胞分裂を介して子孫に伝えられる性質のものであることも意味している。同様な現象は、ラットにおける放射線誘導乳がんの場合にも見られ、非遺伝性事象ががんを誘導するために組織の微細環境における乳腺幹細胞の細胞分裂が必須であると報告されている(Kamiya et al., 1995)。
4)放射線によるバイスタンダー効果と遺伝的不安定性
最近、放射線の発がん機構を理解する上で極めて重要な非遺伝的現象が注目されている。それは、“バイスタンダー効果”と“遅延型影響”である。バイスタンダー効果は、被ばくした細胞から周辺の被ばくしなかった細胞へ遠隔的に被ばくの情報が伝えられる現象で、ギャップジャンクションを介した細胞間情報伝達機構の関与や放射線被ばくした細胞から培養液に放出(分泌)される物質の関与が考えられている6)。遅延型影響は、放射線被ばくによって生じた初期の損傷を乗り越え生き残った細胞集団に“遺伝的不安定性”が誘導され、長期間に渡って様々な遺伝的変化が非照射時の数〜数 10 倍の高い頻度で生じ続ける状態が続く現象である。
これらの結果は、低線量放射線の発がん影響を考える上で、非標的影響を考慮することが極めて重要であることを示唆している。すなわち、いずれの現象でも、放射線で直接ヒットされなかった細胞であっても発がんする可能性が高いことを意味している。従って、これまで低線量被ばく時の放射線発がん危険度算定の根拠は、放射線の一次効果は放射線によってエネルギーが付与されるかどうかという物理的確率論にあったので、どんなに少ない線量でも放射線量と生体影響は比例関係にあるとする直線仮説が用いられていた。しかし、低線量放射線被ばく時にバイスタンダー効果のために被ばくしていない細胞で発がんが起きるならば、低線量域における発がん頻度を過小評価している可能性がある。こうした効果は、素線量が大きい高 LET 放射線や低 LET 放射線であっても 5mGy 程度以下の低線量で顕著になる。この線量では、個々の細胞の核を一つか二つの電子飛跡が横切ることになるが、被ばくしない細胞が全体の 37%、1 飛跡の被ばくを受けるのが 37%、2 飛跡の被ばくが 18% となり、被ばくしない細胞の割合が大きくなるので無視できない。もしこういった現象が起きているとすれば、従来、信じられてきた“発がんは DNA 損傷が原因となって生ずる突然変異によって生ずる”とする“発がんの突然変異説”に重大な疑問が生ずる。
しかし、依然として、遺伝的不安定性の起源となる初期損傷と不安定性を長期間維持する仕組みは不明なところが多い。遺伝的不安定性は、X 線など DNA 切断を起こす要因では誘導されるが,紫外線など切断を生じない要因では誘導されないことから、遺伝的不安定性の原因となる初期損傷は、DNA 二重鎖切断である可能性が高いと推測されている。また、遺伝的不安定性の誘導量は、小線量放射線の事前照射で低減化できるので、遺伝的不安定状態は DNA 二重鎖の修復過程で何らかの持続可能な細胞内変化が生ずることが原因となる可能性も十分に考えられる7)。さらに、遺伝的不安定になった細胞では、活性酸素種の産生が持続的に亢進し、持続的に遺伝子を攻撃し続けており、遅延型影響の発現に、細胞内における活性酸素の存在状態が密接に関係しているようである7,8)。放射線によって生じた二重鎖切断が修復される際に大規模な遺伝子欠失を伴う再結合が起きた際、その再結合領域に潜在的に不安定なクロマチン領域(クロマチン不安定領域;Potentially Unstable Chromatin Region; PUCR)が形成されるが、その構造は細胞内にそのまま存在し続けても細胞の生存に直接影響せず世代を越えて子孫細胞へ伝達されるので、この PUCR が遺伝的不安定性を記憶する仕組みかもしれない9)。PUCRの存在は、テロメア不安定性を誘導する10,11)。
5)がん化した細胞では、染色体の数の異常が起きている
それでは、何が細胞がん化の直接の原因であろうか?依然として不明なまま残された疑問である。我々の研究では、放射線でがん化した細胞では、3 番や 11 番染色体数が増加し、15 番染色体が減少するなど特定の染色体の数に変化が起きていることがわかった。いわゆる異数化である。しかし、この時点では、染色体の構造異常の増加は観察されない。同様の染色体の異数化は、放射線被ばく時に限らず、高密度培養によって誘導されたがん化細胞でも観察される。これらのことは、染色体の異数化が細胞がん化に密接かつ普遍的に関係する現象であることが予想できる。がん細胞で染色体の異数化が高頻度に起きることは、古くから多くの研究者が観察しており、このことからがん細胞では、染色体不安定化が生じていると考えられてきた。しかし、我々は、染色体の異数化は、がん細胞の特性であるというより細胞がん化の最初の引き金として重要な役割を果たしているのではないかと疑っている。ヒト細胞でも、一日 1cGy の低線量γ線を反復照射されると細胞形態の悪性化とそれに伴う染色体異数化を極めて高頻度に起こす。しかし、マウス細胞と異なり不死化することは殆どなく、これがヒト細胞を実験的にがん化できない理由となっている。
なぜ染色体の異数化が起きるか、未だに明らかではない。Hansemann は、100 年以上前に、様々な癌組織切片を観察して、がん組織では、不均等分裂、分裂後期架橋と多極分裂が高頻度にみられることを発見している。これら三つの異常は染色体数の増加や減少の原因となる。しかし、乳がんなどある種の固形癌では、最初にみられる染色体変化は、異数化ではなく倍数化であることが報告され、倍数化した細胞から染色体が分裂とともに抜け落ちて異数化する経路の存在が予想されている。どのようなメカニズムでこうした倍数化が起きるかは、明らかにされていないが、最近、倍数化した細胞の染色体に形態的にバランスのとれた相互転換(rearrangement)が存在することやテロメラーゼを持たない細胞で 4 倍体細胞ができやすいことが注目されている。染色体の不安定化にテロメアが関与している可能性が示唆されている。事実、放射線被ばくは、細胞のテロメアを短縮させ染色体末端の不安定化を起こす。不安定になった染色体末端は、融合(fusion)し染色体架橋(bridge)を生じさせ、分裂期に再切断(break)につながる FBB サイクル稼働のきっかけとなり、不安定化した染色体は様々な構造異常を生み出してゆくことになる。この機構は、魅力的であるが、二動原体染色体が再切断して核と細胞質分裂を終えることができた細胞が実際に生き延びる確率は、細胞がん化頻度と比べて極めて低いと思われ、この経路が放射線による細胞がん化の主計路である可能性は低いと思われる。この推測は、中国の高自然放射線地域に住む住民の血液細胞では、二動原体染色体の頻度が増加しているが、住民のがん罹患率は低いという疫学調査の結果にも矛盾しない。さらに、染色体数の変化は分裂装置であるセントロゾーム(centrosome)数の変化と連動する。もっとも、現時点では、中心体の数的変化が細胞がん化の引き金なのか?細胞ががん化した結果なのか?明確な回答はない。しかし、乳がんの 80% 以上で、染色体構造異常や数的異常が、中心体の数的異常と相関することが知られている。我々の研究でも、放射線被ばくや高密度培養によって、セントロゾームの数が異常になることが明らかである。
これら一連の結果は、テロメアやセントロゾームが放射線発がんの一次標的である可能性は極めて高いことを示唆している。
6)放射線発がんの標的はタンパク質である
我々は、これまでの 30 年にわたる放射線細胞がん化の研究成果を総合的に解釈して、放射線発がんの一次標的は、DNA そのものではないと強く信ずるようになった。その想いを確実にしたのは、ビタミン C による放射線の遺伝的効果軽減効果の研究成果である。生体の 80% 以上は水であるため、遺伝的影響を含めて、放射線の生物影響の主因は水の放射線分解で生じた OH あるいは H ラジカルによる DNA 損傷が直接の原因であると考えられてきた。しかし、我々は、1990 年初頭から見られるようになった“細胞内の水の分布が均一でなく DNA 近傍はかなり疎水性である”とする報告を考慮して、これまでの常識的な考え方と違って、“OH ラジカルの様な活性ラジカルは直接 DNA を攻撃しないのではないか?”という疑問を持った。
その後、我々は、X 線照射された細胞内に実際に生じたラジカルを直接観察する技術を開発し、細胞内に常温における半減期がおよそ 20 時間と長く活性の低い高分子ラジカル(長寿命ラジカル)が誘導されることを発見した12)。この長寿命ラジカルは、ビタミン C 処理で効率良く捕捉され、その消失に伴って突然変異と細胞がん化頻度が低下する13)。さらに驚くべきことに、ビタミンC処理による長寿命ラジカル捕捉効果と突然変異や細胞がん化頻度の軽減効果は、X 線照射が終了した後、20時間を経た細胞でも観察されることが判った。一方、DMSO 処理は活性の高い OH・ ラジカルや O2- ラジカルを効果的に捕捉でき、それに伴って細胞致死や染色体異常誘導を抑制することができる。しかし、DMSO 処理を X 線照射後に行ってもその効果は、全く認められない。一方、最近、このラジカルが、酸素存在環境では、システインに生じた有機ラジカルであることを明らかにした14)。これらの結果を総合的に判断して、我々は、X 線照射によって細胞内に生じた短寿命ラジカルは、遺伝物質(DNA)を直接攻撃し細胞死や染色体異常を起こすが、長寿命ラジカルは、遺伝物質(DNA)を直接攻撃せず致死や染色体異常を起こさない。しかし、突然変異や細胞がん化を引き起こす主因となると結論している。
こうした我々の実験結果と推測が正しいとすると、現在、最も受け入れられている発がん機構説であり“DNA 損傷→染色体異常→突然変異→発がん”という経路で発がんが起きるとする”発がんの突然変異説”に疑問を投げ掛けるものとなる。
7)結論
これまでの我々の研究成果は、放射線による細胞がん化(ひいては個体における発がん)の直接原因は、DNA であると考えるよりも、DNA 以外のタンパクであると考える方が矛盾なく説明することができる。我々は,放射線発がんの第一次標的は、タンパクであると考えたい。この仮説が正しければ、放射線発がんのリスクを DNA 標的説をもとに評価することはできない。
8)参考文献(略)